Cum conversia energiei chimice în electrice
Conversia energiei chimice în energie electrică asociat cu fenomenul de disociere electrolitica, esența care constă în formarea particulelor încărcate - ioni când se dizolvă substanțele neko toryh (acizi, săruri, etc.).
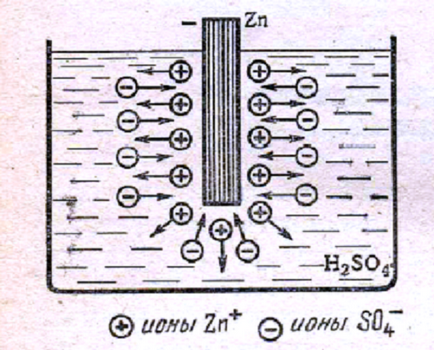
Figura. 1 placă de zinc într-o soluție de acid sulfuric.
Fig. 1 prezintă o placă de zinc, a redus într-o soluție apoasă de acid sulfuric (electrolit). Zincul se dizolvă în electro-Lite, soluția a fost transferată la sex-ioni au fost Zn +. Soluția percepe Xia pozitivă și zinc - negativ, dar. dizolvarea zincului din cauza
forțe chimice.
Aria de contact zinc - solutia un motor electric de ioni de câmp produs direcționat la întindere hoț la zinc.
Deoarece dizolvarea zincului crește încărcătura, și împreună cu ei, câmpul electric. Electrice pe les contracarează tranziție Zn + ioni în soluție, astfel încât la o anumită dizolvare zinc sute di- oprește.
O astfel de stare de echilibru corespunde egalității dintre cele două forțe care acționează asupra ionilor de Zn +: chimic, în care se dizolvă zincul și dizolvarea prevenirea electrice. Vorenus zinc în prezența unei diferențe-Tial terminații poten Rust? 1 între zinc și sodiu.
Dacă aceeași soluție este de a plasa o placă din alt material, procedeul descris va avea loc, de asemenea, în acest caz. Dar a primit diferența de potențial Nye? 2 poate fi o altă valoare - mai mult sau mai puțin? 1.
Conform acestui principiu este format e. d. a. celula electrochimică și baterie (fig. 2 a, b).
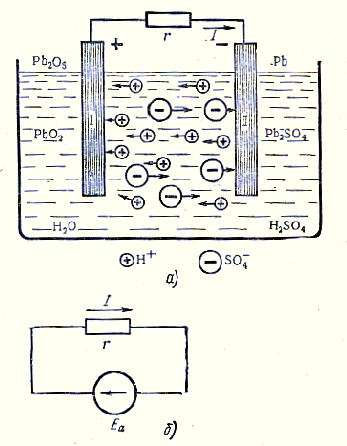
Figura 2. Baterie în modul de încărcare de plumb.
Când unește plăcile I și II într-un conductor circuit închis va acționa e. d. a. element chimic
și un curent electric este stabilit.
În acest caz, e. d. a. Este creat și menținut prin acțiunea forțelor chimice element (forța laterală), și, prin urmare, putem vorbi despre conversia energiei chimice în energie electrică.
Curentul electric în elementul galvanic-CAL este însoțită de procese electrochimice ireversibile, care pot descrie sat-definite reacții chimice.
Utilizarea celulelor electrochimice este limitată - la un moment dat pot da cantitate numai nezna-sem de electric TION energie, iar termenul muncii lor este scăzută și se termină atunci când substanța activă a electrozilor într-o anumită măsură, va izras-hodovano.
În mod semnificativ mai-Application-set au baterii, procese electro-chimice, care pe-inversabile. Reversibilitatea proceselor electrochimice, iCal permite CHECK DIT repetate de încărcare și baterii de timp rând. Când încărcarea se acumulează o anumită cantitate de energie chimică consumată datorită energiei electrice și pentru descărcarea această energie poate fi utilizată în circuitul electric sub formă de energie electrică.