Sintetizat pe ribozomi proteinele sunt livrate la locurile de desfășurare a activității lor în moduri diferite - studopediya
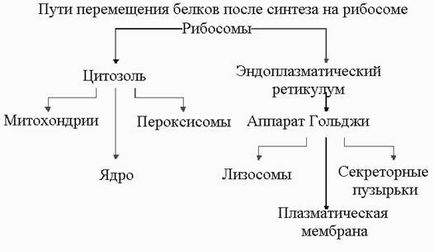
Celulele eucariote contin organite celulare, fiecare fiind format din căile de circulație a proteinelor speRisShema după sinteză pe ribozomului.
Proteinele. din Pacificul Numai o mică parte din aceste proteine pot fi sintetizate in cadrul organite, iar cea mai mare parte sintetizate pe ribozomi și care are nevoie de mecanismele lor de livrare ale acestor proteine. În citoplasmă celulelor eucariote, există două populații izolate spațial de ribozomi. Unele dintre ele (ribozomi asociate cu membrana), sunt situate pe suprafața opusă a membranei în citoplasmă ER (ER brută) și angajate sinteza proteinelor, care au fost transferate imediat în ER. Altele (ribozomi libere) nu este atașată la membrană și produce toate celelalte proteine codificate de către nucleu. ribozomilor bound și libere sunt identice în structură și funcție. Ele diferă numai pe proteine care sunt sintetizate pe ele la un moment dat. Dacă ribozomului se duce la sinteza proteinelor cu o peptidă semnal pentru ER, atunci un astfel de semnal direcționează ribozomului la membrana ER.
Proteinele sintetizate de ribozomii liber, - proteine destinate citoplasmă sau de a încorpora în mitocondrii, nucleul sau cloroplast. Proteinele destinate mitocondrii nou sintetizat (și probabil un mecanism similar pentru chloroplast) cuprind secvențe specifice de aminoacizi (adică, secvențe de semnal), la capătul său N - secțiuni de capăt. Multe peptide semnal ale proteinelor sunt încărcate pozitiv resturi de aminoacizi, care sunt alternate cu hidrofobe. Secvențele semnal nu oferă doar o inserție de proteine in membrana, dar, de asemenea, servi ca un semnal care promovează proteina exacte și orientate transport către locul de funcționare. Printre direcția proteine
șoc Figura Proteine de căldură permite trecerea proteinelor din citosol în matricea mitocondrială.
-Core care guvernează în cele mai multe peptide semnal a format un grup de resturi de aminoacizi încărcate pozitiv. In cele din urma, unele proteine din citosol peptide semnal inerente, care sunt legate covalent de acid gras, direcționând aceste proteine la membrane un rol important în mecanismul de transfer al acestor proteine aparțin unei clase speciale de proteine, cunoscut sub numele de chaperones. Funcția acestor proteine nu se limitează la participarea la transferul proteinei. Chaperones constau din mai multe lanțuri de polipeptide care formează cavitatea intramolecular cu un număr de suprafețe hidrofobe în interiorul cavității. Această cavitate acționează în calitate de custode al lanțurilor polipeptidice ale moleculei sintetizat din Misfolding și agregarea intermoleculare. Cel mai bine studiat - chaperones de membri ai familiei de proteine „șoc termic“ (HSP). Aceste proteine sunt produse în bacterii ca răspuns la efectele termice. Ele sunt clasificate ca regulă, greutate moleculară. Distinge familie HSP70, HSP60, etc. Proteinele care interacționează cu chaperone sunt dislocate și livrate la locul receptorului pe membrana organelle. proteină desfăcută este apoi trecut printr-o poarta speciala, situat in membranele mitocondriale interioare si exterioare. În timpul transportului se produce proteine specifice de recunoaștere pentru membrana de spațiu mezhmebrannogo sau matrice. În cazul în care complexul trece în matrice, proteina poate fi adoptată Chaperones vnutriorganelnymi pentru pliere finală. N - secvența terminală este îndepărtată în timpul transportului
Proteinele sintetizate în endoplasmatic proteinele retikulume- sherehovatom destinate membranelor celulare, lizozomi, sau transportul extracelular cu ajutorul unui sistem special de sortare implicând reticulul endoplasmatic sherehovaty (RER) și complexul Golgi. SHARE - reprezentată printr-o rețea de bule interconectate, înconjurate de o membrană în interiorul citoplasmei. La exterior, suprafața citosolic a bulelor aranjate polizomilor care conferă vedere membrană sherehovaty. Golgi în structura seamănă cu SHARE, este alcătuită dintr-un teanc de vezicule mici, înconjurate de membrană, nu interconectate și nu sunt acoperite de ribozomi. Golgi acte complexe ca un „centru de comutare“ proteinelor pentru diverse scopuri.
Proteine, dintre care transportul este asociat cu complexul Golgi, poliribozomilor sintetizate asociate cu SHARE urmează
1. Ribozom începe sinteza N - secvența hidrofobă capătul de intrare (semnal) la mARN citoplasmatic.
2. Particulele de semnal de recunoaștere a secvenței semnal (SRPS), constând din mai multe proteine și ARN mic (7SL) recunosc secvențele lider de proteine sintetizate corespunzătoare și se leagă de ele imediat ce acestea părăsesc ribozomului. Această conexiune este oprită temporar de emisie, atâta timp cât N - secvența lider terminală, a coborât din ribozomului nu în contact cu o proteină de legare specială în membrana RER.
3. Această proteină se leagă la COTA ribozom și secvența lider este inserat în membrana RER.
4. SRP separate și traducerea este reluată.
5. proteina Sintetizat se extinde de fapt, prin procesul dependent de ATP cu membrană.
6. Înainte de difuzare este completă, secvențele lider îndepărtat legat de membrană protează. Proteinele sunt eliberate în lumenul RER și sunt supuse unei continuare sortare. Proteinele care au rămas în reticulul endoplasmatic, au puternice peptide specifice de semnal la capătul C-terminal și, astfel, să rămână legat la SHARE membranei
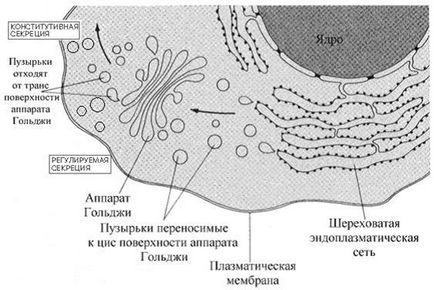
Rolul complexului Golgi - Lumenul RER, proteinele sunt supuse primele faze aparatului Ris.Rol Golgi în secreția proteinelor de către celulă.
glicozilare (vezi mai jos). Veziculele care transportă proteine mugur de RER și sa mutat la complexul Golgi, unde capetele de finalizare glicoproteinelor de carbohidrați și jumătate. vezicule membranare ale complexului Golgi - proteine modificate multi-strat de sortare arena. Bulele de COTA vin mai întâi la cis Golgi complexă de suprafață (de suprafață situate în apropierea RER) și îmbinate (combinat) cu rezervoare cu membrană Golgi. Proteinele sunt apoi a trecut din nou prin bule în straturile intermediare. În final, unele dintre bule otshnurovyvaetsya suprafață complex trans Golgi (cel mai departe de RER) și să participe la formarea de lizozomi, peroxizomi sau glioksisom sau livrate în membrana plasmatică. O parte a proteinei având o secvență specifică (secvența semnal KDEL (Lys-Asp-Glu-Leu)) „este prins“ receptori membrane Golgi și complexat cu receptorul în reticulul endoplasmatic este returnat de transportul retrograd.
transportul vezicular de proteine din complexul Golgi necesită o mare specificitate în mișcare scop. Încălcarea transportului vezicular - cauza haosului celulare. Vezicule de membrana care transportă ambalate în flacoane etichetate proteine proteine membrana specifice. In unele cazuri, veziculele membranare cuprind proteine complementare (numite capcane), care interacționează cu alte membrane și fuziune cauza membranei și de livrare suportate proteine exacte.
Proteinele secretate din celulă, ca parte a bulei (transport vezicular) pot părăsi celula în mai multe moduri. O distincție este secreție constitutivă și reglementată. Reglementate la importanța mecanismelor de secreție este dat unui clathrin special de proteine (vezicule acoperite cu clathrin franjurate).
Clathrin - proteina fibrilara conservatoare (18O kD) care formează, împreună cu o altă polipeptidă (35 kDa) caracteristică de acoperire de suprafață poliedrică pe așa-numitele bule mărginite. Principalul component structural servește ca o acoperire a unui complex proteic trivalent (triskelion), constând din trei lanțuri de polipeptide clathrin și trei polipeptide mai mici. formă triskelion bule de pe suprafața mărginită korzinopodobnye cu ochiuri sase si pentagoane. Triskelion izolate în condiții adecvate sunt capabile de agregare spontană. Cu toate acestea, chiar și în absența unor bule care formează coșuri tipice cu multiple fațete. Celelalte proteine incluse în vezicule membranare mărginite este aparent responsabil pentru legarea membranelor vezicula filmate clathrin cu și receptorii de captare din plasma gropi și vezicule membranare mărginită.
Mecanismele de secreție constitutive implicate franjurate neklatrinovye bule.
In bacterii, caracteristicile proteinelor de transport. Proteinele bacteriene destinate secretiei (translocarea prin membrana celulară) conține porțiuni foarte hidrofobe de aminoacizi (numite secvențe semnal sau secvențe lider) la regiunea lor N-terminală. După proteina trecut prin membrana, secvența lider este îndepărtată.
Modelul actual acceptat de translocare este prezentat în ris.10-14. Secvența evenimentelor este după cum urmează:
O proteină care este implicată în translocație (numit pro-proteină) - formează un complex cu Chaperone citoplasmatice (de exemplu, proteină Sec B). complex de proteine protejează împotriva colaps prematur, ceea ce ar împiedica să treacă prin pori. pe
Fig. mecanism de transport prin intermediul proteinelor membranei in bacterii.
Din urmă constă din două proteine transmembranare Sec E și Sec Y. Sec A - ATPase, care facilitează translocare. Odată ce pro-proteina va trece prin membrană, peptidă lider este îndepărtată legată de membrană protează. iar proteina poate plia în forma sa activă tridimensională.